Suggestion about Modernized Classification of Herbal Medicinal Preparations in Dual Medical Systems
Article information
Abstract
Objectives:
The main purpose of this study is to find a solution for modernized classification of herbal medicinal preparations in dual medical systems. Through this study, we expect to provide a reasonable foundation of herbal medicine for public health.
Methods:
We studied legal or technical terms of herbal medicinal preparations from the past regulations, and through this procedure, we could suggest clear definitions of terms for herbal medicinal preparations. We also investigated documents for approval of herbal medicinal preparation from US, EU(European union), The People’s Republic of China, Japan, so that we can refer to them to revise regulation for appropriate use of herbal preparations.
Results:
In Korea pharmaceutical affairs act, any basis of ‘Crude drugs’ does not exist. But in some subordinary notifications, the way that they use the ‘Natural product medicine’ is used as a means of limiting basic rights of doctor or pharmacist of Korean medicine compared to doctor or pharmacist. At the same time, in subordinary notifications, provisions are vague and not enough for scientific evidence of Korean medicine. Thus, we re-categorized herbal medicinal preparations into new drugs, drugs made from herbal medicinal preparations and suggested requirements for drug approval.
Conclusions:
Instead of using the term ‘Crude drug preparations’, and we should use term ‘Herbal medicinal preparations’ in related act and notification. And also we suggest to amend subordinary regulations and documents for approval of herbal medicinal preparations. Through this, we can make herbal medicinal preparations be more industrialized.

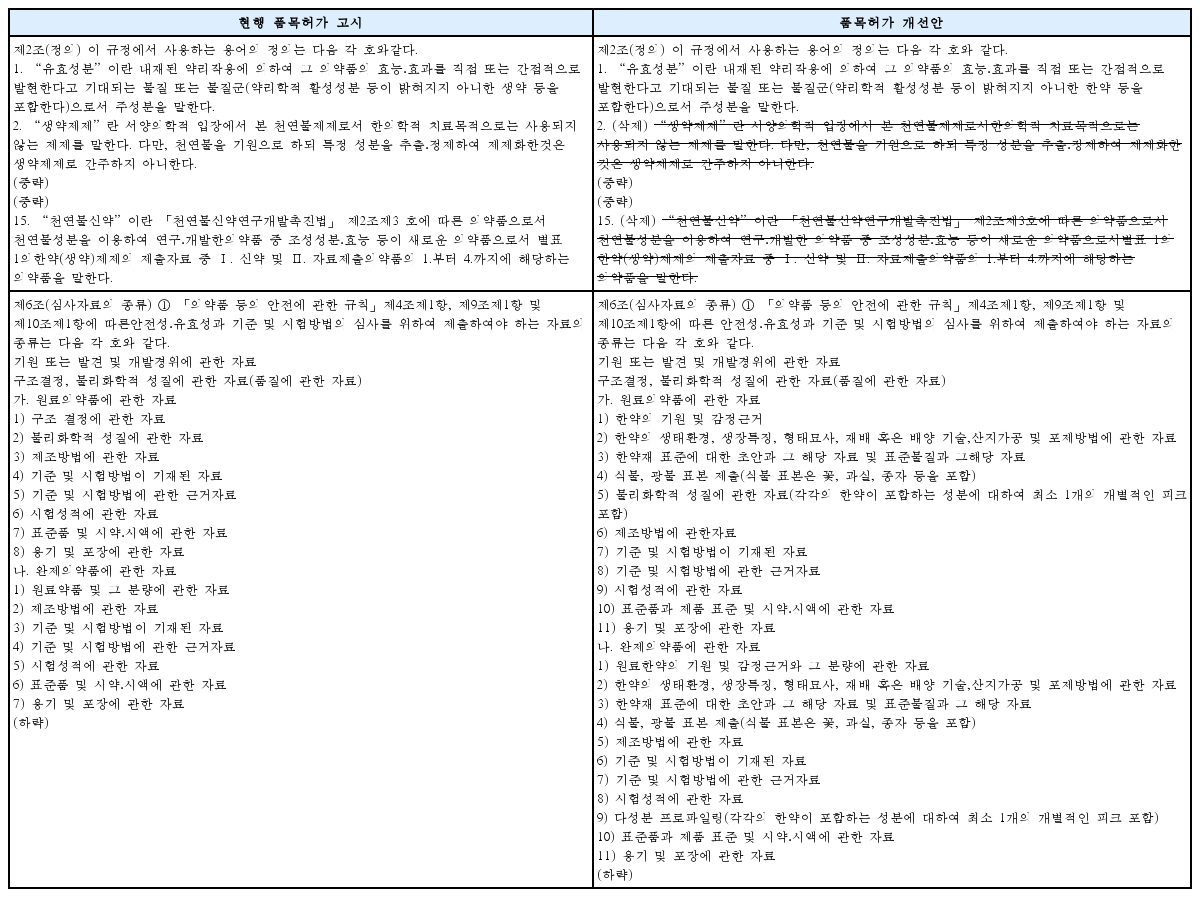
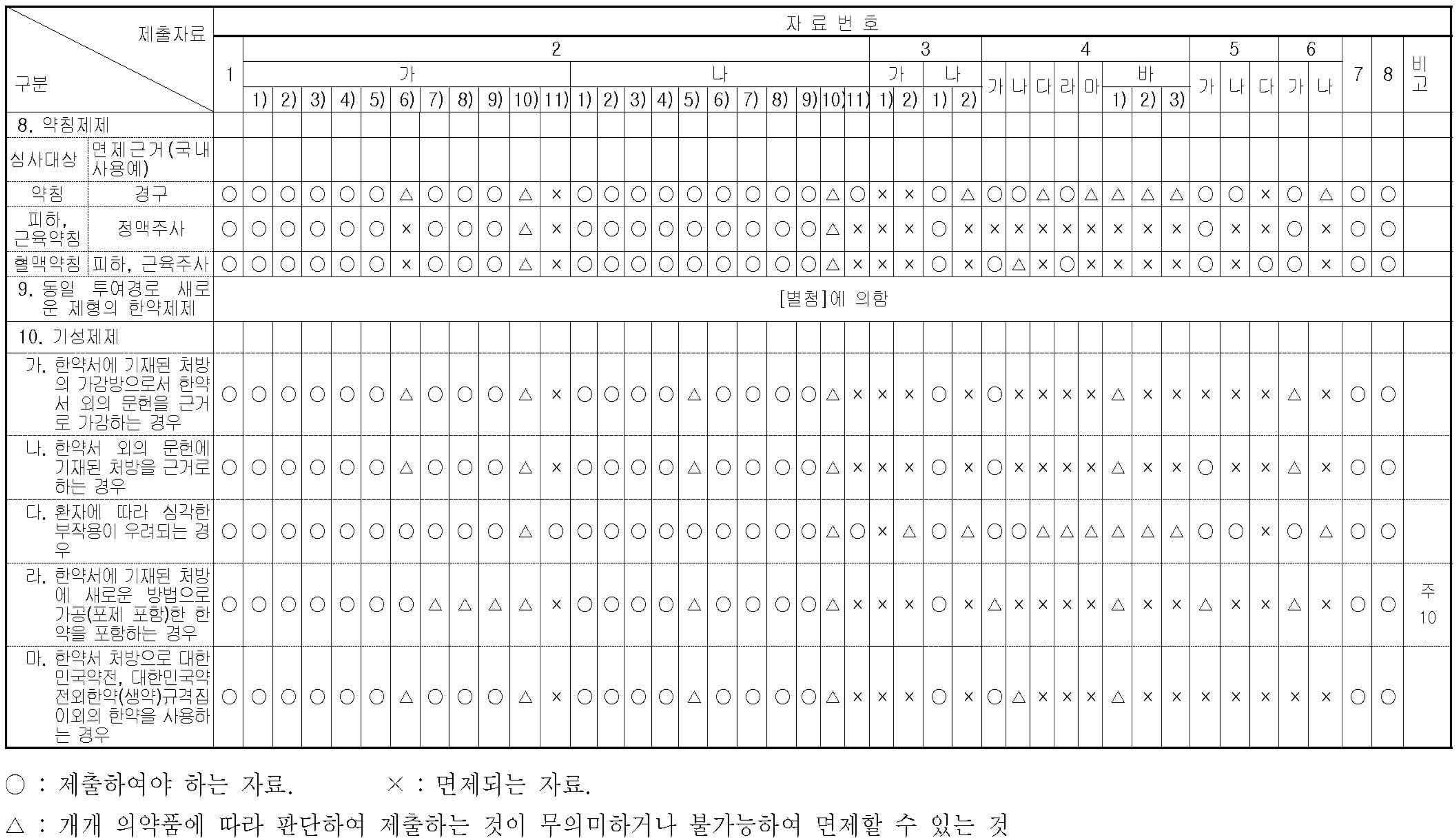
Category Classification According to Submitted Materials from Regulation on Herbal Medicinal Preparations (Crude Drugs) Approval and Notification

Category Classification According to Submitted Materials from Regulation on Herbal Medicinal Preparations (Crude Drugs) Approval and Notification : Herbal Medicinal Preparations

Amendment of Regulation on Herbal Medicinal Preparations Approval and Notification : Attached Table I
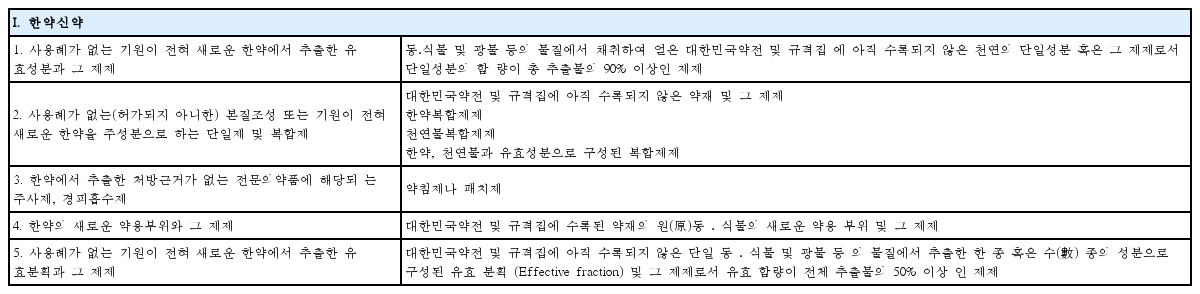
Amendment of Regulation on Herbal Medicinal Preparations Approval and Notification : New Herbal Medicinal Preparations